Blog Archives
CELIACHIA
La celiachia, intolleranza permanente al glutine, fino a non molti anni fa era considerata una malattia rara e quindi, anche per questo motivo, poco conosciuta.
La malattia, già descritta nell’antichità da Areteo di Cappadocia nel II secolo d.C., fu messa in relazione all’introduzione di farina circa 1700 anni dal pediatra olandese Dicke (8), che aveva acutamente osservato come le condizioni di bambini affetti da questa condizione fossero paradossalmente migliorate durante il cosiddetto „inverno del digiuno”(1944-45) quando, a causa della penuria di cibo, i piccoli pazienti erano sfamati con patate, cipolle o alimenti inconsueti come bulbi di tulipano.
Per 18 secoli, e sin dopo la II guerra mondiale, la malattia sembrò avere un quadro clinico uniforme. L’elevata mortalità infantile soprattutto per malattie infettive, verso cui i celiaci sono più vulnerabili, selezionò una coorte di adulti „non celiaci”, cosicché la malattia era considerata una patologia pediatrica, identificabile dalla comparsa, dopo poche settimane o mesi dall’introduzione di alimenti solidi, del quadro di grave malnutrizione (diarrea abbondante e maleodorante, distensione addominale, ipotrofia delle masse muscolari, arresto della crescita). Pertanto i primissimi studi di tipo epidemiologico, dopo l’identificazione dell’agente causale, erano rivolti ad una popolazione infantile: in quei tempi, la malattia era diagnosticata esclusivamente sulla base della sintomatologia tipica ed era considerata rara (1: 8.000 negli anni ’50). Negli anni ’60, con l’avvento dei primi test di assorbimento e della biopsia digiunale per-orale, le diagnosi aumentarono, tanto che nella metà degli anni ’70 furono riportati picchi di 1: 500 per regioni come Irlanda, Scozia, Svizzera.
Di conseguenza, nella speranza di „prevenire” l’insorgenza della malattia, si ritardò l’introduzione del glutine allo svezzamento con il risultato immediato di una netta riduzione dell’incidenza della malattia. Sfortunatamente tale decrescita fu puramente illusoria, poiché gli studi successivi dimostrarono che la riduzione delle forme tipiche infantili era controbilanciata dall’insorgenza di forme atipiche, con sintomatologia insorgente in bimbi più grandi o nell’adulto. Nelle ultime decadi le nostre conoscenze sulla malattia celiaca sono molto migliorate, ed a tale miglioramento ha contribuito notevolmente la gastroenterologia italiana. Grazie al prolungamento della sopravvivenza, all’avvento di tecniche di screening affidabili ed a studi su campioni di popolazioni, si è chiarito che la malattia è molto più eterogenea e frequente di quanto non si potesse pensare, sia per prevalenza sia per espressione clinica.
La malattia celiaca è stata paragonata ad un iceberg, in cui la parte sommersa (ovvero le forme atipiche e silenti) supera notevolmente la parte emersa, rappresentata dai casi tipici, con le classiche stimmate del malassorbimento e perciò facilmente diagnosticabili.
I segni obiettivi possono essere molto variabili. Sono ormai rari i casi in cui il grave stato denutrizionale induce l’immediato sospetto.
In questi ultimi anni, la celiachia sembra aver cambiato le proprie caratteristiche: in realtà è solo mutata la nostra attenzione verso sintomi spesso sfumati ed atipici, che ha permesso di accertare un maggior numero di diagnosi 4, (13-15). Grazie all’avvento di marcatori sierologici di celiachia (27,28,) in particolare gli anticorpi antiendomisio (EmA) e più recentemente gli anticorpi antitransglutaminasi (tTG) dotati di elevata sensibilità e specificità, nonché alla diffusione dell’endoscopia digestiva con possibilità di effettuare biopsie a livello della seconda porzione duodenale (29,30) la malattia, considerata sino a pochi anni fa diffusa prevalentemente fra la popolazione europea, è stata riscontrata in tutti i continenti, con una frequenza sovrapponibile. La celiachia è una delle malattie croniche su base genetica, non mortali, più comuni, con una frequenza, nella popolazione generale, stimata 1:100-1:300. Colpisce individui di entrambi i sessi, anche se con una prevalenza maggiore in quello femminile (F/M = 2,5/1). L’età media di comparsa è intorno ai 35 anni, sebbene possa esordire in età sia pediatrica che geriatrica (il 20% dei pazienti celiaci ha più di 60 anni). L’incidenza della malattia è elevata, particolarmente in alcuni paesi dell’Europa occidentale, dove è sovrapponibile a quella americana (0,3-1%).
Colpisce individui di entrambi i sessi, anche se con una prevalenza maggiore in quello femminile (F/M = 2,5/1). L’età media di comparsa è intorno ai 35 anni, sebbene possa esordire in età sia pediatrica che geriatrica (il 20% dei pazienti celiaci ha più di 60 anni).
L’incidenza della malattia è elevata, particolarmente in alcuni paesi dell’Europa occidentale, dove è sovrapponibile a quella americana (0,3-1%).
In Italia un recente studio multicentrico ha riscontrato una percentuale di malattia celiaca pari a un soggetto ogni 100 persone , tuttavia la maggioranza delle persone affette non sa di averla.
A causa dell”alto numero di casi sommersi si parla di fenomeno dell’iceberg a proposito di questa patologia.
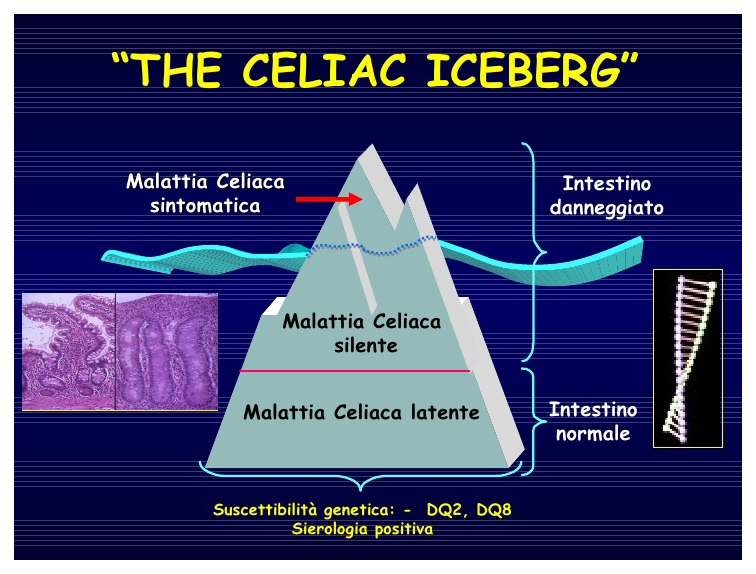 L’individuazione precoce della parte sommersa dell’iceberg celiachia rappresenta ancora oggi il più grave problema di questa malattia: esiste infatti un’alta percentuale di celiaci (circa l’80%) non ancora diagnosticati che, oltre ad avere una bassa qualità della vita, rischia gravissime complicanze e ciò anche in relazione alla frequente associazione con molteplici malattie a patogenesi autoimmune. Maggiore è il ritardo diagnostico maggiore è l’autoimmunità associata.
L’individuazione precoce della parte sommersa dell’iceberg celiachia rappresenta ancora oggi il più grave problema di questa malattia: esiste infatti un’alta percentuale di celiaci (circa l’80%) non ancora diagnosticati che, oltre ad avere una bassa qualità della vita, rischia gravissime complicanze e ciò anche in relazione alla frequente associazione con molteplici malattie a patogenesi autoimmune. Maggiore è il ritardo diagnostico maggiore è l’autoimmunità associata.
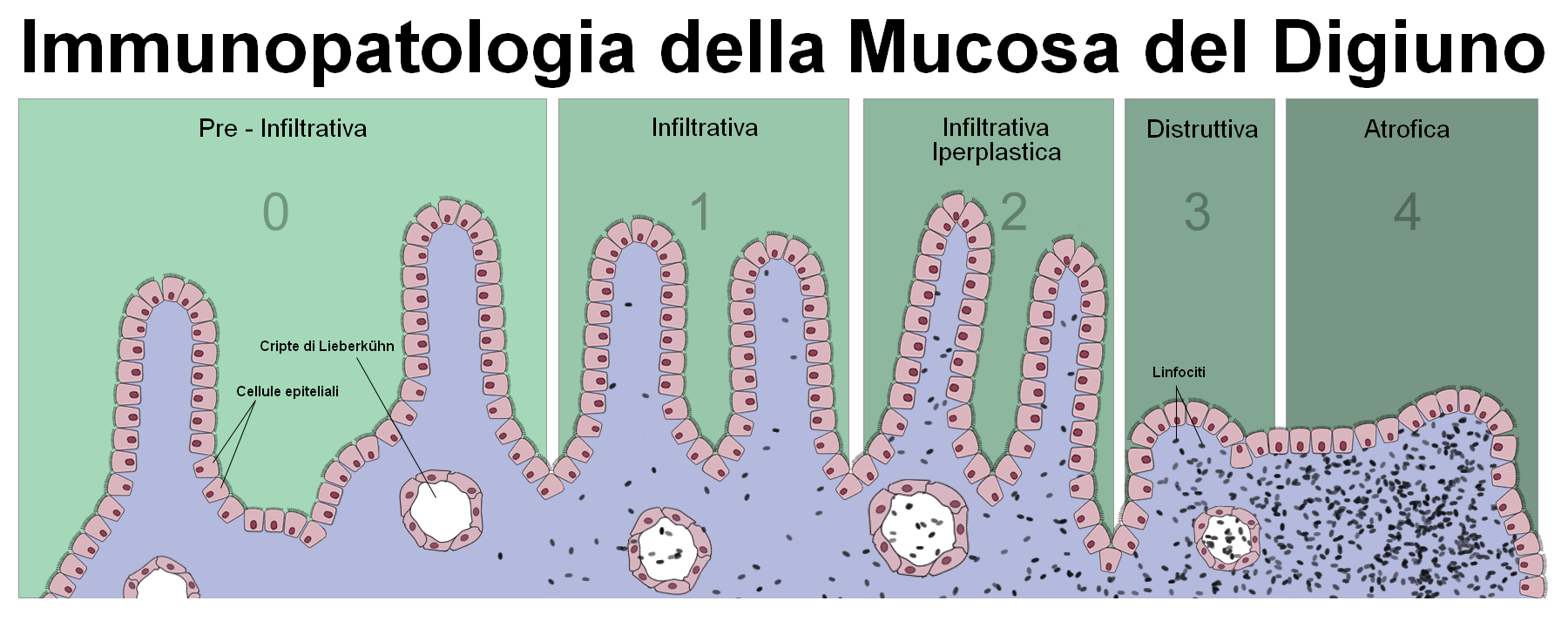
La malattia celiaca, conosciuta anche come sprue celiaca o enteropatia da glutine, è una malattia dell’intestino tenue a patogenesi immuno-mediata, caratterizzata da una intolleranza permanente al glutine, frazione proteica presente in molti cereali (frumento, farro, kamut, orzo, avena, segale, spelta e triticale) che, in soggetti geneticamente predisposti, causa un danno mucoso che, progredendo attraverso vari stadi di gravità, conduce all’atrofia della mucosa del piccolo intestino.
Una diagnosi tardiva può quindi cronicizzare l’infiammazione determinando patologie gravi, a volte irreversibili, come osteoporosi, infertilità, aborti ripetuti, bassa statura nei ragazzi, diabete, tiroidite autoimmine, alopecia, epilessia con calcificazioni cerebrali, linfoma intestinale, artrite eumatoide, epatite cronica attiva, dermatite erpetiforme.
L’esclusione completa dei cereali contenenti glutine dalla dieta determina la regressione delle lesioni a carico della mucosa intestinale e risoluzione del quadro clinico.
EPIDEMIOLOGIA
Colpisce individui di entrambi i sessi, anche se con una prevalenza maggiore in quello femminile (F/M = 2,5/1). L’età media di comparsa è intorno ai 35 anni, sebbene possa esordire in età sia pediatrica che geriatrica (il 20% dei pazienti celiaci ha più di 60 anni).
L’incidenza della malattia è elevata, particolarmente in alcuni paesi dell’Europa occidentale, dove è sovrapponibile a quella americana (0,3-1%). In Italia un recente studio multicentrico ha riscontrato una percentuale di malattia celiaca pari a 1/100
SI NASCE O SI DIVENTA CELIACI?
Chi è geneticamente* predisposto diventa celiaco, ma solo dopo l’introduzione del glutine nell’alimentazione, il che mette in moto una risposta immunitaria abnorme a livello dell’intestino tenue, cui consegue una infiammazione cronica con alterazioni morfologiche dei villi intestinali (appiattimento). Ma avere la predisposizione genetica non implica necessariamente la manifestazione della patologia.
L’esistenza di una predisposizione genetica a sviluppare la celiachia è suggerita dal rischio aumentato in
1) fratelli di pazienti celiaci 7-12%
2) fratelli di pazienti celiaci HLA identici 30-50%
Gemelli monozigoti 80%
Gemelli dizigoti 20%
* Nella celiachia è stata dimostrata una forte associazione con i geni del complesso HLA-II codificanti gli eterodimeri DQ2 e DQ8; il 90% circa dei celiaci è portatore dell’antigene DQ2, mentre nella maggior parte dei celiaci DQ2-negativi si riscontra positività per DQ8.
Esiste tuttavia un 25-30% della popolazione che pur possedendo questi geni di predisposizione non svilupperà mai la malattia. Infatti la presenza degli alleli HLA è un indicatore di predisposizione alla celiachia.
 TEST GENETICO
TEST GENETICO
Il test genetico è di notevole aiuto quando sia necessario escludere la malattia celiaca e determinante in caso di malattia refrattaria all terapia.
Il test genetico è indolore. Si effettua con un semplice tamponcino buccale.
A chi è consigliato il test:
– alle persone che hanno un familiare affetto da celiachia
– a chi dopo aver effettuato esami sierologici ha ricevuto una diagnosi per morbo celiaco dubbia
– a chi soffre di sintomi gastrointestinali, diarrea, dolori addominali, sindrome del colon irritabile e non ne conosce la causa.
ESPRESSIONE CLINICA
Accanto alle forme classiche, che si manifestano entro i primi due anni di vita con segni e/o sintomi di malassorbimento, sono stati identificati anche quadri cosiddetti atipici, caratterizzati da un esordio tardivo, spesso clinicamente sfumato o addirittura silente.
Sulla base dei dati clinici, sierologici ed istologici è, infatti, possibile riconoscere le seguenti forme (classificazione estensiva della celiachia):
FORMA CLASSICA: sintomi enterici, sierologia e biopsie intestinali positive
FORMA ATIPICA: manifestazioni extraintestinali, sierologia e biopsie intestinali positive
FORMA SILENTE: asintomatica con sierologia e biopsie intestinali positive
FORMA LATENTE: sierologia positiva, biopsie intestinali negative
FORMA POTENZIALE: predisposizione genetica
Le percentuali maggiori sono appannaggio delle forme silente ed atipica.
QUANDO PENSARE ALLA CELIACHIA IN ETA’ ADULTA
• Anemia carenziale resistente a trattamento, non ben spiegata
• Disturbi gastro-intestinali: alvo irregolare, meteorismo, dolori addominali
• Bassa statura, scarso accrescimento
• Problemi di infertilità; aborti spontanei
• Disturbi neurologici non ben definiti (atassia, neuropatie periferiche)
• Parenti di primo grado di pazienti celiaci
• Soggetti Down
• Osteoporosi precoce e severa
• Ipertranasaminasemia sine causa
• Aftosi orale recidivante
• Dermatite erpetiforme
• Alopecia areata
MANIFESTAZIONI CLINICHE DELL’APPARATO DIGERENTE
I principali dati della letteratura evidenziano che nell’adulto la presentazione clinica della celiachia con manifestazioni di tipo gastroenterologico rappresenta meno del 5% di tutti i casi.
I sintomi gastrointestinali sono manifesti soltanto nella cosiddetta “forma classica”, nell’ambito della quale possiamo distinguere:
• malattia conclamata, con grave sindrome da malassorbimento e, quindi, diarrea, steatorrea, meteorismo e calo ponderale;
• malattia paucisintomatica, con scarsi o lievi sintomi addominali (gonfiore, anomalie dell’alvo);
• malattia monosintomatica, con presenza soltanto di due sintomi, diarrea e ipertransaminasemia.
Alla celiachia possono associarsi, con differente prevalenza, numerose malattie gastroenterologiche, quali la sindrome dell’intestino irritabile, la stomatite aftosa ricorrente, il reflusso gastroesofageo e l’ipertransaminasemia.
La sindrome dell’intestino irritabile (IBS), è caratterizzata da un quadro generale del tutto simile a quello della celiachia paucisintomatica: è pertanto verosimile che molte diagnosi di intestino irritabile sottendano in realtà una malattia celiaca non opportunamente riconosciuta.
Dall’analisi dei dati della letteratura si evince come la celiachia presenti una prevalenza del 5% nei pazienti con IBS rispetto ad una prevalenza dello 0,6% nella popolazione di controllo.
MANIFESTAZIONI EXTRAINTESTINALI
I dati della letteratura indicano che in circa il 60% dei casi l’esordio della malattia celiaca è caratterizzato da manifestazioni extraintestinali con scarsi o nulli sintomi gastrointestinali.
In generale possono essere distinte in due gruppi:
a) Secondarie alla malattia non trattata : Bassa statura. Alterazione del peso. Anemia sideropenica. Osteoporosi. Artriti. Neoplasie. Difetti dello smalto dentario. Ritardo puberale. Alterazioni della fertilità. Miocarditi. Epatite.
b) Associate alla malattia: Malattie autoimmuni.Malattie dermatologiche. Disturbi neurologici e psicologici.Sindromi genetiche.
Nel bambino la malattia celiaca determina un arresto della crescita.
La perdita di peso era in passato un quadro clinico caratteristico del paziente celiaco.
Al contrario il sovrappeso può essere un quadro che non esclude la celiachia: il 30% dei soggetti con diagnosi di malattia celiaca è in sovrappeso.
La carenza di ferro, con o senza anemia, sembra essere la manifestazione extraintestinale più frequente, in particolare in coloro che non rispondono alla supplementazione orale di ferro:
• il 50% dei celiaci adulti manifesta anemia
• nel 20% dei casi l’anemia è l’unico sintomo
• > 70% dei pazienti ha carenza di ferro
Il 6-14% dei pazienti anemici è celiaco
DIAGNOSTICA
A partire dagli anni 80 con la comparsa dei primi marcatori sierologici il laboratorio è diventato componente fondamentale del percoso diagnostico della malattia celiaca. La corretta diagnosi non può che essere la risultante della necessasria interazione tra clinico e laboratorista a partire dagli ni con la comparsa i primi arcatori. In soggetti in cui si sospetti la malattia celiaca si effettuano in primis test non invasivi (diagnostica di laboratorio) rappresentati dal dosaggio di:
• AGA (anticorpi Antigliadina IgA ed IgG) non usato negli adulti.
Nei bambini di età inferiore ai 2 anni sono fortemente indicativi di celiachia anche in assenza di EMA e TTG
• TTg (anticorpi Antitransglutaminasi tissutali IgA) ricombinanti umani si sono mostrati più sensibili degli EMA
• Ema IgA (anticorpi antiendomisio IgA) possono essere assenti nei celiaci di età inferiore ai 2 anni.
La “conferma diagnostica” si ottiene, tuttavia dall’ esame istologico della mucosa digiuno-ileale previa effettuazione dell’esame bioptico in corso di endoscopia:
TRATTAMENTO DELLA CELIACHIA
la dieta senza glutine, condotta con rigore, è l’unica terapia che garantisce al celiaco un perfetto stato di salute. Consiste nell’esclusione del glutine dalla dieta, cui consegue la normalizzazione dei parametri sierologici, del quadro istologico e della sintomatologia, quindi: guarigione clinica. Il soggetto celiaco deve evitare tutti i prodotti contenenti glutine e sostituirli con alimenti naturalmente privi di glutine o con speciali alimenti del commercio privi di glutine, il cui simbolo di riconoscimento è rappresentato, a livello internazionale, dalla spiga di grano sbarrata. La scritta “senza glutine” può essere posta in etichetta solo dopo la concessione, da parte del Ministero della Salute, di una specifica autorizzazione allo stabilimento di produzione e la notifica al Ministero stesso del singolo prodotto da parte di questo. E’ disponibile il prontuario degli alimenti per celiaci: è una pubblicazione dell’AIC (Associazione Italiana Celiachia), strumento fondamentale nella quotidianità. In questo libro vengono raccolti tutti gli alimenti che si trovano in commercio le cui aziende produttrici garantiscono l’assenza di glutine.
Inoltre su sito dellAIC (http://www. celiachia .it/afcristoratori/) è possibile consultare l’elenco sempre aggiornato dei ristoranti, pizzerie , alberghi, bar ,pasticcerie , agriturismi che hanno aderito al progetto „alimentazione fuori casa” dell’associazione e che sono informati sui problemi dell’alimentazione dei celiaci.
CAFFEINA
Una tazzina di caffè è per noi italiani un’abitudine a cui difficilmente possiamo rinunciare. Ma è veramente salutare? E lo è per tutti?
La caffeina è una sostanza naturale di origine vegetale (un alcaloide), che si trova in diverse piante come i chicchi di caffé e i semi di cacao, le foglie di tè, le bacche di guaranà e le noci di cola, e che viene utilizzata in barrette dietetiche e bevande energizzanti, prodotti erboristici analgesici, cosmetici anticellulite,nonché in molti altre specialità farmaceutiche acquistabili senza ricetta medica. Agisce come pesticida naturale, proteggendo le piante dagli insetti che si nutrono di loro. La caffeina fu identificata per la prima volta nel caffè nel 1820 da un giovane medico tedesco: Ferdinand Runge. Secondo un’antica leggenda furono i monaci sufisti dello Yemen i primi a scoprire nel XV sec. gli effetti delle bevande contenenti caffeina per tenersi svegli durante le ore di preghiera. Da allora la pausa per il caffè è diventata un’abitudine per svegliarsi e ricaricare le pile.
Metabolismo della caffeina
La caffeina è bene assorbita per via orale e livelli significativi della sostanza si rinvengono nel plasma nei 30 minuti successivi alla sua assunzione, mentre il picco plasmatico si raggiunge dopo due ore dall’inizio dell’assorbimento, che si completa nell’arco di 90 minuti (Blanchard and Sawers, 1983). La caffeina ha un volume apparente di distribuzione (Vd) di circa 1.06 l/kg (Lelo et al., 1986), il che implica una sua ripartizione uniforme in tutta l’acqua corporea, tanto che la caffeina, dopo assorbimento completo, si ritrova in concentrazioni simili in tutti i distretti dell’organismo, compreso l’encefalo. La caffeina, inoltre, è in grado di attraversare liberamente la placenta e di pervenire al feto, nonchè di accumularsi nel latte materno (Oo et al., 1995). La caffeina subisce un esteso metabolismo epatico di primo passaggio, come dimostrato dal fatto che solamente il 10% del farmaco perviene ai reni senza aver subito modificazioni (Butler et al., 1989). L’emivita plasmatica della caffeina è di circa 3-5 ore con valori variabili a seconda del soggetto considerato. Un elevato valore di emivita plasmatica è, infatti, riscontrabile nei bambini (Pons et al., 1988), verosimilmente a causa dello sviluppo incompleto degli enzimi metabolici epatici, e nelle donne in stato di gravidanza, dove esiste un equilibrio di distribuzione con il feto (Khanna and Somani, 1984). La gravidanza rallenta il tempo nel quale la caffeina viene metabolizzata e una donna incinta di solito mantiene valori di caffeina per un tempo più lungo. Al contrario, l’emivita plasmatica della caffeina è ridotta nei fumatori, poichè i prodotti di combustione del tabacco inducono gli enzimi epatici che metabolizzano le xantine (Zevin and Benowitz, 1999). La capacità della caffeina di aumentare la soglia di allerta e di sostenere l’attenzione più a lungo è stata ben documentata, e il suo principale modo di agire come stimolante del sistema nervoso centrale è dato dalla sua azione di antagonista dell’adenosina. L’adenosina è una sostanza chimica, prodotta in modo naturale, che agisce da messaggero nella regolazione dell’attività cerebrale modulando lo stato di veglia e di sonno (è un “segnale di stanchezza”). La caffeina blocca i recettori per l’adenosina presenti nel tessuto nervoso, in particolare nel cervello, mantenendo lo stato di veglia. Attraverso questo meccanismo la caffeina può potenziare la capacità di realizzare uno sforzo fisico e mentale, prima che si presenti la stanchezza. Il blocco di recettori dell’adenosina può inoltre essere responsabile della costrizione dei vasi sanguigni, che allevia la pressione dell’emicrania e del mal di testa, e spiega perché molti analgesici contengono caffeina. Ulteriori funzioni dimostrate sono :aumento della sintesi acida a livello gastrico, aumento della diuresi e, se applicata sulla cute tramite cosmetici specifici (creme, gel e patch), risulta utile nel trattamento delle adiposità localizzate. Come poche altre sostanze inoltre, ha la capacità di passare rapidamente la barriera emato-encefalica, nonché di attraversare la placenta ed essere presente nel latte materno. La caffeina è anche un inibitore della cAMP-PDE (AMP ciclico fosfodiesterasi) che converte il cAMP (adenosinmonofosfato ciclico) nella sua forma aciclica (cAMP –> AMP). Poiché il cAMP è secondo messaggero per l’azione dell’adrenalina, ridurre l’attività della fosfodiesterasi significa prolungare l’effetto di adrenalina/epinefrina e sostanze simili come anfetamina, metanfetamina e metilfenidato .
Caffeina e Salute
La risposta all’assunzione di caffeina è comunque estremamente variabile da persona a persona, e in passato numerose ricerche hanno dimostrato che questa variabilità ha in buona parte delle basi genetiche. In un articolo pubblicato sulla rivista Psychopharmacology viene presentata una rassegna delle principali scoperte fatte negli ultimi anni per quanto riguarda le relazioni tra DNA e consumo/effetti della caffeina. E’ stata esaminata gran parte della letteratura scientifica sull’argomento, che ha permesso di evidenziare quanta genetica ci sia realmente dietro al nostro rapporto con la caffeina, oltre a ricordare tutte le varianti genetiche associate alla risposta a questo alcaloide, nel breve e nel lungo periodo.
Il modo in cui rispondiamo alla caffeina è davvero scritto nei nostri geni? Beh, sembrerebbe proprio di sì. Per valutare quanto una caratteristica sia dipendente dal DNA e non, ad esempio, da fattori ambientali, vengono realizzati i cosiddetti twin studies, ossia delle ricerche dove vengono messe a confronto coppie di gemelli monozigoti con coppie di gemelli eterozigoti: il vantaggio è che all’interno di entrambe le coppie l’influenza ambientale è la stessa, ma soltanto i monozigoti sono identici anche nel patrimonio genetico. Applicando a questi studi dei modelli matematici, è possibile calcolare l’ereditabilità di un certo tratto, ad esempio la risposta alla caffeina: è un valore che va da 0 a 1 ed è un buon indicatore di quanto la variabilità che si osserva per quel particolare comportamento è spiegabile geneticamente. Ebbene, tutti gli studi effettuati nel corso degli ultimi anni concordano nell’assegnare un valore di ereditabilità medio-alto (compreso tra 0,30 e 0,60) a diversi tratti legati alla caffeina, come ad esempio il consumo giornaliero, la tossicità, la tolleranza, le crisi di astinenza e l’insonnia. Addirittura, il consumo particolarmente elevato di caffeina ha mostrato un valore di ereditabilità pari a 0,77: i bevitori di caffè più accaniti (più di 625 milligrammi al giorno) sembrerebbero quindi subire l’influenza genetica molto più dei consumatori moderati.
Una volta appurato che il modo in cui la caffeina produce i suoi effetti sull’organismo è dipendente in gran parte dal codice genetico, sono stati presi in esame i singoli geni, per trovare quelli che, variando, possono modificare questi effetti. L’isoenzima 1A2 del citocromo P-450 è uno di questi. Ha il compito di metabolizzare la caffeina, trasformandola in dimetilxantina: in questo modo, la molecola viene smaltita. Il gene che codifica per questo enzima, CYP1A2, presenta sulla sua sequenza un polimorfismo importante, cioè un punto di variazione dove una base azotata piuttosto che un’altra possono fare la differenza.Una sostituzione di una C al posto di una A (CYP1A2*1F) in posizione -163 del gene CYP1A2, diminuisce l’attività enzimatica alterando il metabolismo della caffeina. I portatori dell’allele CYP1A2*1A (-163A) sono dei metabolizzatori “rapidi”, mentre gli individui omozigoti per la variante CYP1A2*1F sono dei metabolizzatori “lenti”. Il protrarsi nel circolo sanguigno della caffeina prolunga tutti gli effetti psicostimolanti della sostanza (tachicardia, tremore, insonnia, ansia e vampate di calore) e aumenta il rischio di infarto al miocardio. E’ stato osservato, ad esempio, che fumatori con genotipo A/A (vale a dire che in quella posizione hanno una A sia nell’allele paterno che nell’allele materno) sono in grado di metabolizzare la caffeina molto più velocemente. Se invece andiamo a guardare gli effetti della caffeina sul lungo termine, pare che i genotipi C/C siano i più propensi ad avere infarti non fatali, in seguito al consumo di caffeina. In particolare, in un importante studio del 2006 pubblicato nel Journal of the American Medical Association , Cornelis et al. hanno monitorato circa 4000 individui di cui 2000 reduci da infarto del miocardio; considerando altri fattori variabili come il consumo del cibo, l’attività fisica o lo stato socio economico, la loro ricerca ha evidenziato come le persone a metabolizzazione lenta di caffeina secondo il gene CYP1A2, erano associate ad un alto rischio di infarto , rischio che aumenta, anche in base al numero di tazzine consumate. Il pericolo di infarto cresce del 36% nei metabolizzatori lenti che bevono due o tre tazze di caffè al giorno”, concludono i ricercatori, e si arriva fino al 64% per i forti consumatori di caffè, ossia coloro che ne consumano quattro o più tazze al dì. E il rischio è doppio se di età inferiore a 59 anni, quadruplo se minori di 50″. Al contrario, chi ha la versione del gene associata a rapido metabolismo della caffeina risulta protetto dal rischio infarto, sempre che non si abusi di caffè. Inoltre nell’Aprile del 2005 Sata et al. hanno pubblicato una studio sul Journal of Molecular Human Reproduction,nel quale si metteva in relazione la caffeina con la fertilità e la gravidanza. Questo studio ha dimostrato che le donne con il gene codificante il metabolismo lento per caffeina hanno un rischio maggiore di abortire e di ridurre la fertilità se consumano da una a tre tazze di caffè al giorno,mentre le donne a metabolizzazione veloce non corrono questi rischi pur consumando le stesse quantità di caffè. Altri polimorfismi interessanti sono stati individuati nei geni codificanti per i recettori di adenosina e dopamina, entrambi coinvolti nella risposta alla caffeina: si è visto che particolari genotipi possono provocare più facilmente stati di ansia nel consumatore, mentre altri sono legati ai disturbi del sonno. La risposta alla caffeina è legata a doppio filo con alcune patologie neurodegenerative: lo stesso recettore per l’adenosina è associato ad esempio al morbo di Parkinson e alla malattia di Huntington. Comprendere le modalità attraverso cui il nostro DNA ci rende più o meno sensibili agli effetti della caffeina ci aiuterà probabilmente anche a studiare nuove cure per queste malattie.
GENETICA
La caffeina è metabolizzata nell’organismo dall’enzima Citocromo p450 1A2 (CYP1A2).
Il citocromo CYP1A2, uno dei membri della famiglia dei citocromi P-450, è un enzima del fegato altamente polimorfico ed e’ responsabile del metabolismo di circa il 5-10% dei farmaci attualmente in uso clinico, tra cui i più importanti sono alcune clozapine, imipramine, caffeine, fluvoxamine, paracetamolo, phenacetina, theophyllina e tacrine. CYP1A2 inoltre è coinvolto nell’attivazione metabolica di alcune amine aromatiche e quindi espleta un ruolo primario nella carcinogenesi da tossine chimiche, come quelle trovate nel fumo da sigaretta. Alcuni studi sul metabolismo CYP1A2-dipendente della caffeina o phenicetina hanno dimostrato che quest’enzima è espresso a vari livelli nel fegato tra differenti individui, suggerendo un controllo polimorfico dell’attivita’ enzimatica. Esiste una considerevole variabilità nell’attivita’ metabolica del CYP1A2 dovuta a fattori genetici, ambientali e ad interazioni tra farmaci. CYP1A2 puo’ essere sia indotto che inibito da molti farmaci e interazioni farmaco-cibo.
Test genetici e Polimorfismi investigati:
Esistono test genetici che consentono di rivelare se una persona è un metabolizzatore lento o veloce della caffeina. L’indagine genetica attualmente in uso consente di genotipizzare 3 alleli del gene CYP1A2, che rappresentano oltre il 98% delle varianti alleliche conosciute per questo gene. Sono due le varianti del gene che riguardano la metabolizzazione della caffeina nell’organismo. La variante allelica CYP1A2*1A codifica l’enzima che metabolizza la caffeina in maniera rapida, mentre l’allele CYP1A2*1F quello a metabolizzazione lenta. Gli individui che posseggono due copie dell’allele CYP1A2*1A sono metabolizzatori veloci della caffeina, mentre le persone che presentano anche solo un allele del CYP1A2*1F sono metabolizzatori lenti.
Genotipi risultanti dal test:
- Omozigote CYP1A2*1F Metabolizzatore lento
- Eterozigote CYP1A2*1F Metabolizzatore lento
- Omozigote CYP1A2*1A Metabolizzatore rapido
Gli individui che metabolizzano lentamente la caffeina devono monitorare la dose quotidiana. Se la consumano in maniera eccessiva infatti (più di 2 o 3 tazze di caffè o 200 mg di caffeina al giorno) possono avere effetti negativi sul loro organismo (tachicardia, tremore, insonnia, ansia e vampate di calore) incluso un aumentato rischio di infarto.
Chi deve utilizzare il test?
Tutti i grandi consumatori di caffè o di bevande,alimenti contenenti caffeina, chiunque voglia trarre vantaggio dai più recenti studi scientifici che indicano come migliorare sensibilmente lo stile di vita e mantenersi in buona salute, le donne con abortività ricorrente o problemi di infertilità i cui esami specialistici diagnostici a riguardo non hanno rilevato la causa.
CAFFEINA: COME MONITORARE LA DOSE
Contrariamente a quanto si crede, la quantità di caffeina non dipende dal volume di caffè bevuto. I dati medi di contenuto di caffeina sono: per una tazza o una lattina di tè circa 20-30 mg di caffeina, una di cioccolata 10 mg, una lattina di Coca-Cola normale, Diet o di Pepsi circa 40 mg e una Red Bull 80 mg. Il contenuto di caffeina in una tazza di caffè può dipendere da molti fattori, per esempio:
- a) il metodo di preparazione
- b) la miscela usata
- c) la quantità di caffè usata
Per quanto riguarda la miscela, una miscela robusta ha un contenuto 2,5 volte più alto di caffeina di una miscela arabica.
Contenuti di caffeina di alcune bevande o alimenti selezionati:
| PRODOTTO | QUANTITÀ | CAFFEINA (mg) |
|---|---|---|
| Espresso | Una tazzina | 40 |
| Caffè solubile | Una tazza | 95 |
| Caffè “decaffeinato” | Una tazza | 5 |
| Caffè americano | 100ml | 95-125 |
| Caffè fatto con Moka | 35-50ml | 60-120 |
| Tè Lipton | Una tazza | 40 |
| Coca Cola | 1 lattina | 85 |
| Cacao | 100g | 100mg |
| Red Bull | 100ml | 30mg |
Rischi/Benefici
| QUANTITÀ DI CAFFEINA ASSUNTA | RISCHI/BENEFICI PER I METABOLIZZATORI LENTI |
|---|---|
| 1-2 tazze (200 mg) al giorno | Nessun aumento di rischio per infarto |
| 2-3 tazze (300 mg) al giorno | Aumento del rischio di infarto del 36% |
| 4 tazze o più al giorno | Aumento del rischio di infarto del 64% |
| 4 tazze o più al giorno per persone sotto i 50 anni | Rischio aumentato di 4 volte per infarto |
| 100 mg al giorno (donne) | Aumento del rischio aborti ricorrenti e di riduzione della fertilità |
| QUANTITÀ DI CAFFEINA ASSUNTA | RISCHI/BENEFICI PER METABOLIZZATORI RAPIDI |
|---|---|
| 2-3 tazze (300 mg)/al giorno | Diminuzione del rischio di infarto del 22% |
| 100 mg/al giorno (donne) | Nessun aumento di rischio di abortività |
“Gli uomini sono come il caffè. I migliori sono carichi, caldi e possono tenerti su tutta la notte.”
(Susan Savannah)
LATTOSIO
Intolleranza al lattosio
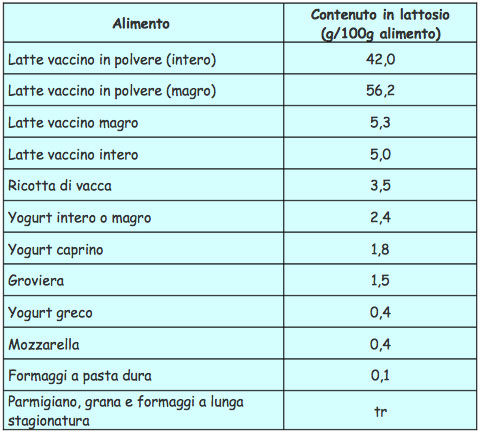
L’intolleranza al lattosio, la più comune intolleranza enzimatica ,deriva dall’incapcità di digerire il lattosio, lo zucchero naturale del latte . Ne soffre circa il 70% della popolazione mondiale. Il 30-40 per cento circa della popolazione italiana ne è affetta, anche se non tutti i pazienti manifestano sintomi. Esistono due forme di intolleranza al lattosio : congenita e acquisita. La prima si può manifestare nel lattante fin dalla nascita oppure, più tardivamente nell’adulto. La forma acquisita è invece secondaria ad altre patologie, acute (salmonellosi, colera enteriti acute) o croniche intestinali (celiachia, morbo di Crohn, linfomi, enteriti attiniche, sindrome dell’intestino irritabile). L’espressione e l’attività della lattasi iniziano a diminuire nella maggior parte delle persone intorno ai 2 anni di vita con una riduzione progressiva geneticamente programmata, ma i sintomi di intolleranza al lattosio raramente si sviluppano prima dei 6 anni.
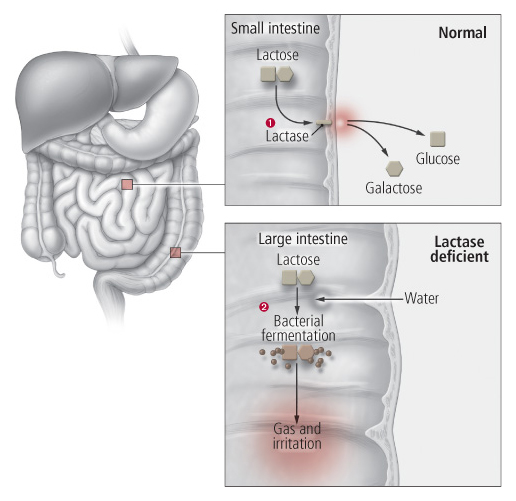
Cos’è il lattosio?
 E’ un disaccaride ossia uno zucchero costituito dall’unione di due zuccheri semplici: glucosio e galattosio. La sua digestione non avviene nello stomaco ma nell’intestino tenue ad opera di un enzima, nota come lattasi, prodotta sempre in tale regione. Detto enzima scinde il lattosio nei due zuccheri semplici che lo compongono: il glucosio ed il galattosio. Successivamente glucosio e galattosio vengono assorbiti dalla mucosa della parete del tenue e passano nel sangue. Nei casi in cui la lattasi è deficitaria, il lattosio non viene completamente digerito e quindi assorbito e di conseguenza si accumula nell’intestino tenue dove richiama liquidi che determinano diarrea. Successivamente passa nel colon che è popolato da una cospicua flora batterica. Per effetto di tali batteri il lattosio fermenta (processo di ossidazione dei carboidrati in ambienti privi di ossigeno ad opera di batteri) provocando sviluppo di gas, per lo più idrogeno ed acido lattico, e quindi flatulenze e feci acide.
E’ un disaccaride ossia uno zucchero costituito dall’unione di due zuccheri semplici: glucosio e galattosio. La sua digestione non avviene nello stomaco ma nell’intestino tenue ad opera di un enzima, nota come lattasi, prodotta sempre in tale regione. Detto enzima scinde il lattosio nei due zuccheri semplici che lo compongono: il glucosio ed il galattosio. Successivamente glucosio e galattosio vengono assorbiti dalla mucosa della parete del tenue e passano nel sangue. Nei casi in cui la lattasi è deficitaria, il lattosio non viene completamente digerito e quindi assorbito e di conseguenza si accumula nell’intestino tenue dove richiama liquidi che determinano diarrea. Successivamente passa nel colon che è popolato da una cospicua flora batterica. Per effetto di tali batteri il lattosio fermenta (processo di ossidazione dei carboidrati in ambienti privi di ossigeno ad opera di batteri) provocando sviluppo di gas, per lo più idrogeno ed acido lattico, e quindi flatulenze e feci acide.
GENETICA
 In origine nella specie umana, come in tutti i mammiferi, la lattasi veniva prodotta nel nostro corpo solo all’inizio della vita (per consentire l’alimentazione col latte materno) e con l’età adulta diminuiva fino alla scomparsa.Nella maggior parte degli adulti di tutto il mondo, la riduzione dell’attività dell’enzima lattasi inizia tra i 2 ed i 3 anni e si completa tra i 5 ed i 10 anni d’età. Esiste una certa percentuale della popolazione che conserva anche in età adulta la capacità di digerire il lattosio perché continua a sintetizzare lattasi , mentre la restante parte della popolazione perde progressivamente negli anni tale capacità. La capacità di digerire il latte è frutto di una mutazione genetica. Il gene che determina la sintesi della lattasi è posizionato sul cromosoma 2.
In origine nella specie umana, come in tutti i mammiferi, la lattasi veniva prodotta nel nostro corpo solo all’inizio della vita (per consentire l’alimentazione col latte materno) e con l’età adulta diminuiva fino alla scomparsa.Nella maggior parte degli adulti di tutto il mondo, la riduzione dell’attività dell’enzima lattasi inizia tra i 2 ed i 3 anni e si completa tra i 5 ed i 10 anni d’età. Esiste una certa percentuale della popolazione che conserva anche in età adulta la capacità di digerire il lattosio perché continua a sintetizzare lattasi , mentre la restante parte della popolazione perde progressivamente negli anni tale capacità. La capacità di digerire il latte è frutto di una mutazione genetica. Il gene che determina la sintesi della lattasi è posizionato sul cromosoma 2.
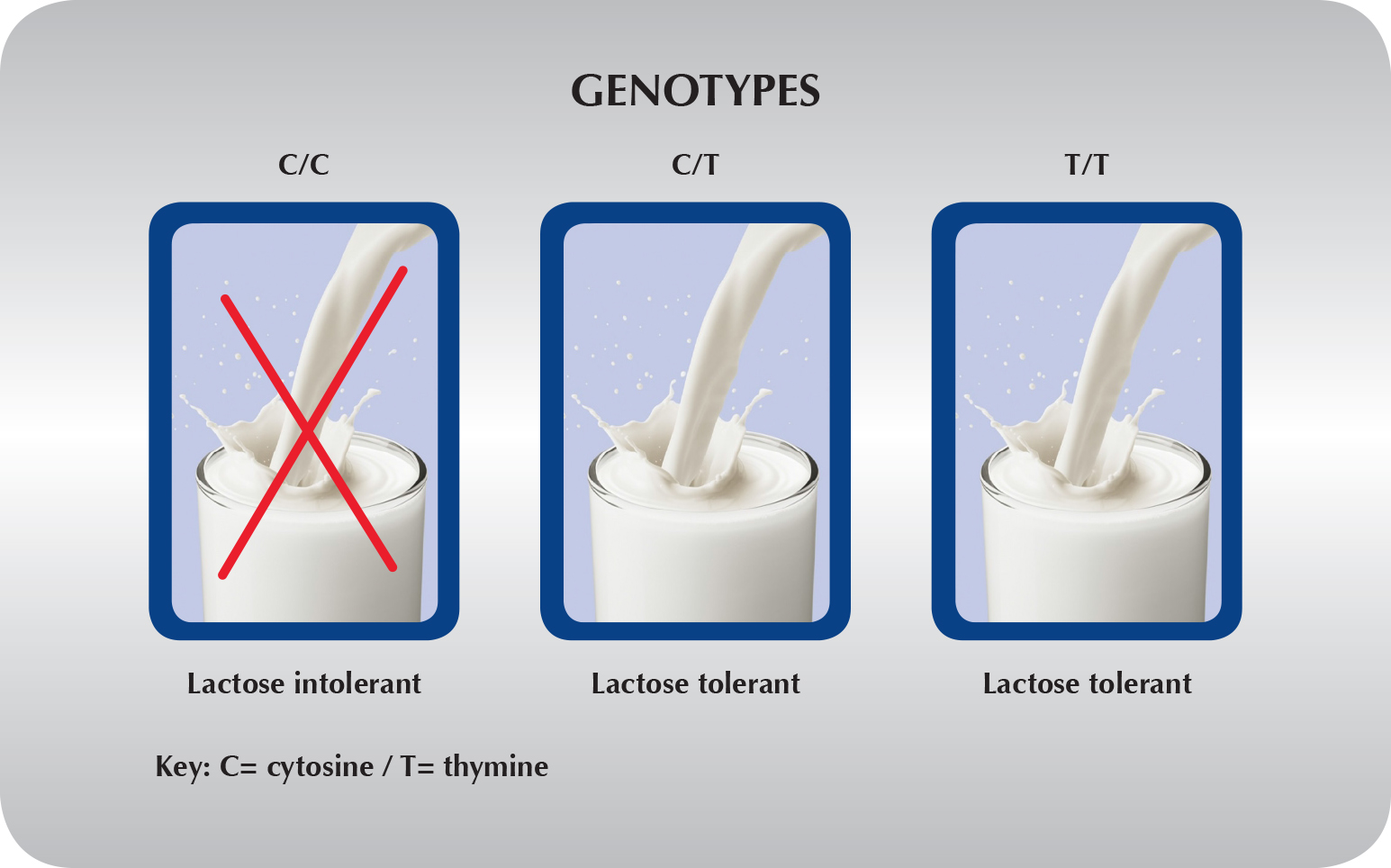
Nel 90% dei casi l’intolleranza al lattosio è riconducibile in Europa a una mutazione del DNA
Un polimorfismo C/T nella posizione -13910, nella regione regolatrice del gene della lattasi, che se è presente in entrambe le copie del gene, può portare a una ridotta espressione di questo enzima nei microvilli dell’intestino tenue, quindi a una carenza di lattasi. Questa ridotta espressione fa sì che con il passare degli anni il lattosio sia digerito sempre meno. La trasmissione ereditaria di questo polimorfismo è autosomica recessiva, cioè solo chi ha entrambe le copie del gene mutate (omozigosi) è affetto da questo tipo di intolleranza. La prevalenza del genotipo C/C (“non persistenza” della lattasi ) è solo del 15% in Germania, mentre nei paesi dell’area mediterranea arriva fino al 50%. In Italia il 30 % circa delle persone presentano il genotipo “non persistenza” della lattasi essendo omozigoti wild type (C/C), il 60% sono eterozigoti (T/C), mentre è raro (10%) il genotipo “tolleranza” (omozigoti T/T). Fino ad alcuni anni fa per verificare l’intolleranza al lattosio veniva effettuato quasi esclusivamte il Breath test all’idrogeno (BTH). Questo test comporta un grande impegno temporale (circa 4 ore da trascorrere in clinica talvolta con manifestazioni gravose dopo l’ingestione del lattosio ed un’adeguata preparazione da parte del paziente nei giorni precedenti il test; nonostante questo alcune circostanze come patologie concomitanti , il fumo, l’assunzione, talvolta obbligata, di certi farmaci possono portare a falsi risutati positivi o negativi. Il test genetico, al contrario, risulta essere rapido, non invasivo e sopratutto fornisce risultati certi circa il rischio di sviluppare intolleranza al lattosio. Il test genetico per verificare la presenza di mutazione C/C prevede l’impiego di un tampone buccale per il prelievo della mucosa orale (dalla parete interna della guancia). Il difetto genetico, indagato con il test , consiste nella sostituzione di una timina (T) con una citosina (C) nella posizione -13910 della regione regolativa del gene della lattasi. Se questa mutazione è presente allo stato omozigote (C/C) si ha una totale deficienza dell’enzima lattasi con conseguente impossibilità di digerire il lattosio. Il test permette di discriminare chi ha entrambe le copie sane del gene (T/T), chi ne ha solo una sana (T/C) e chi le ha entrambe mutate (C/C).
 Essere consapevoli della propria predisposizione genetica a particolari patologie permette di effettuare adeguati e tempestvi cambiamenti nel proprio stile di vita e di istituire efficaci azioni di prevenzione .
Essere consapevoli della propria predisposizione genetica a particolari patologie permette di effettuare adeguati e tempestvi cambiamenti nel proprio stile di vita e di istituire efficaci azioni di prevenzione .
SINTOMI
I sintomi dell’intolleranza al lattosio sorgono perchè il latte non viene digerito a livello intestinale: i più comuni sono:
• Diarrea e feci acquose e non formate causata da un accumulo di lattosio nel tenue e impedisce alle feci di solidificarsi.
• Dolori e crampi all’addome accompagnati da gonfiore e tensione, causati dalla fermentazione del lattosio con degradando in gas (idrogeno) e acidi organici.
• Accentuazione della peristalsi intestinale (movimenti spontanei dell’intestino) con meteorismo e flatulenze.
Possibilità di sangue nelle feci e conseguente dimagrimento ed anemia.
 La sintomatologia può manifestarsi in maniera violenta o contenuta a seconda degli alimenti che si associano al latte e/o suoi derivati. Se con il latte si consumano carboidrati lo svuotamento gastrico sarà rapido e quindi la sintomatologia sarà evidente. Se invece al latte si associano grassi lo svuotamento dello stomaco sarà lento e la sintomatologia molto contenuta.
La sintomatologia può manifestarsi in maniera violenta o contenuta a seconda degli alimenti che si associano al latte e/o suoi derivati. Se con il latte si consumano carboidrati lo svuotamento gastrico sarà rapido e quindi la sintomatologia sarà evidente. Se invece al latte si associano grassi lo svuotamento dello stomaco sarà lento e la sintomatologia molto contenuta.
La sintomatologia è dose dipendente: maggiore è la quantità di lattosio ingerita , più evidenti saranno i sintomi
Trattamento dell’intolleranza al lattosio: la dieta.
Dall’intolleranza al lattosio non si guarisce e non esiste alcun farmaco in grado di contrastare la riduzione della lattasi. Il trattamento perciò si basa essenzialmente su una dieta che preveda alimenti privi di lattosio o con un contenuto estremamente ridotto. Naturalmente poiché la soglia di lattosio tollerata varia da soggetto a soggetto la dieta va calibrata sul paziente.
Cosa mangiare?
Eliminare il lattosio dalla alimentazione non è però cosa semplice come potrebbe sembrare. Infatti il lattosio è presente non solo nel latte e derivati di qualsiasi provenienza (asina, capra, mucca, etc.) ma anche in molti prodotti commerciali in cui viene aggiunto in piccole percentuali per problemi di conservazione. Esempi sono : prodotti da forno come biscotti o merendine, cereali, margarine, surgelati, insaccati, farmaci, etc. Risulta pertanto particolarmente importante per coloro che soffrono di questa intolleranza prestare molta attenzione alle etichette che indicano la composizione degli alimenti. Quando non è possibile eliminare completamente il lattosio dalla dieta è necessario assumere compresse che contengono lattasi in vendita con vari nomi commerciali. E’ infine importante notare che la limitazione nella dieta dei prodotti caseari riduce fortemente l’assunzione di calcio ; pertanto è consigliabile, se non indispensabile, in special modo nei bambini e durante la menopausa, l’uso di appositi integratori o di prodotti fortificati. Un adeguato apporto di calcio risulta essenziale ai primi per un corretto sviluppo osseo e per le seconde per prevenire i problemi di osteoporosi.